p53的发现、进化与结构
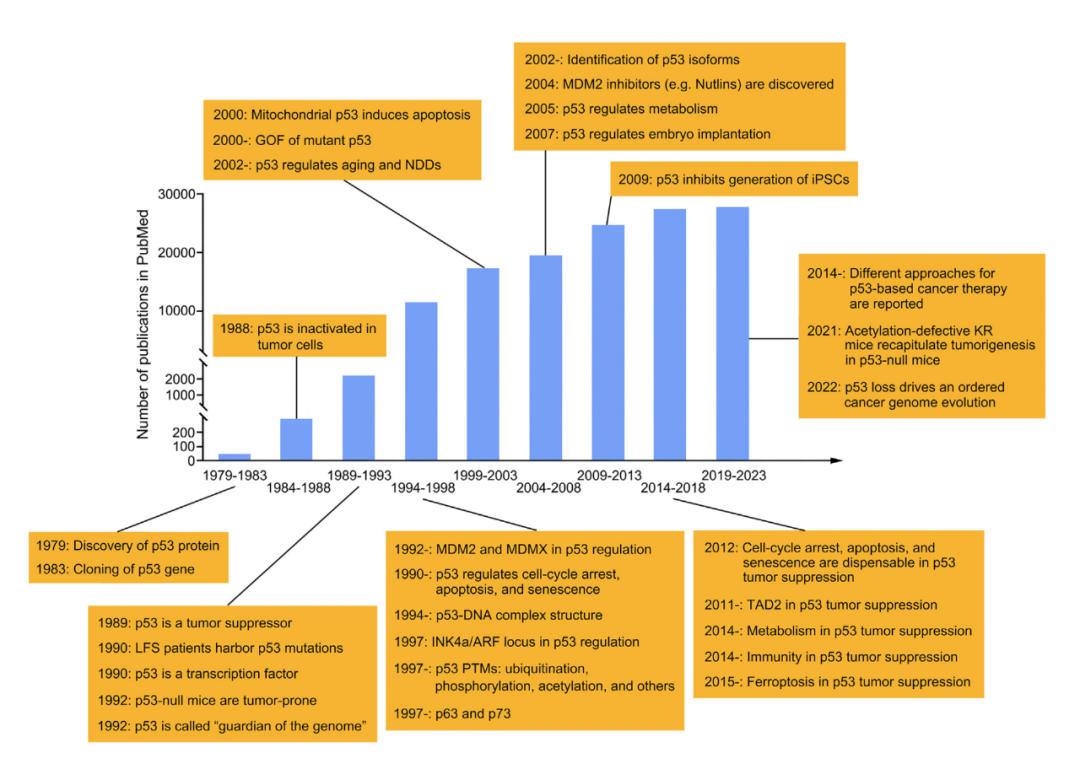
p53的研究在过去几十年经历了几次关键的转折,是现代分子肿瘤学发展的一个缩影。1979年,多个实验室在SV40以及其它方式转化的细胞进行研究时独立发现了p53蛋白。最初,p53被认为是一个促进细胞转化的癌基因。
p53是最重要的抑癌基因,功能广泛而强大。自从1979年p53蛋白被发现以来,p53一直是分子生物学和肿瘤学的“明星分子”。
在 Nature 杂志2017年的一项统计中,p53以绝对优势位列过去几十年最热门研究基因榜第一名。
2024年是p53蛋白被发现45周年。为庆祝这一事件,2024年5月9日,美国哥伦比亚大学欧文医学中心顾 伟教授课题组(刘彦卿博士作为第一作者)应邀在 Cancer Cell 杂志撰写了题为:Understanding the complexity of p53 in a new era of tumor suppression 的长文综述。
该综述全方位地总结了p53的发现、结构、功能、调节、在生理病理过程中的作用、作为疾病治疗靶点的潜力,以及p53研究领域的一些未解之谜。(如下图)
人类p53基因家族包含三个成员p53p63和p73。该家族起源于至少8亿年前,随后发生基因复制和结构多样化从而产生这三个家族成员。一个有趣的发现是p53家族基因存在于一些单细胞真核生物中,例如领鞭毛类Monosiga brevicollis,这表明p53家族在多细胞生物的进化可能存在重要作用。单细胞真核生物中的p53家族基因被认为可以维持基因组稳定性以应对各种刺激。而p53基因出现在最早的脊椎动物中,并在进化上一直保守。鉴于低等生物患癌症的风险极小,p53家族在低等生物中的存在是引人注目的。这就提出了一个关于p53家族在进化中的最原始功能的问题。该家族最初可能参与维持生殖细胞的完整性,其众所周知的肿瘤抑制能力是在很久以后才获得的。
p53蛋白主要是作为一个转录因(TF)调控基因表达,但它也存在TF非依赖的功能。人类的全长p53蛋白(FLp53)包含393个氨基酸,这些氨基酸被组织成五个不同的结构域:N端转录激活结构域(TAD)、富含脯氨酸的结构域(PRD)、中间的DNA结合结构域(DBD)、四聚化结构域(TD)和C端调节结构域(CTD)。p53的 TAD分为两个子结构域TAD1和TAD2。在未受刺激的细胞中,p53蛋白同时以单体、二聚体和四聚体的混合状态存在,其中二聚体占主导地位。在不同类型的刺激信号(包括DNA损伤、癌基因激活、核糖体应激、端粒损伤、营养缺乏和缺氧等),p53蛋白通过其TD快速组装成功能性四聚体(一个“二聚体的二聚体“结构”)。通过使用 DBD,该四聚体可识别位于靶基因启动子或增强子处的p53结合位点以调节转录。p53的DBD折叠很好,其结构已被解析。然而,p53的TAD和CTD存在很多无序区,导致其并没有一个确定的结构。但这一特点有利于它们与转录相关的cofactor相互作用。这些无序区也可能通过与别的蛋白发生相分离介导转录活动。这两个结构域也是进行翻译后修饰 (PTM) 的主要区域。此外,PRD也有助于p53的转录调节活性。p53通过由两个十聚体重复组成的特定反应元件(RE)被招募到 DNA:RRRCWWGYYY(R,嘌呤;W、A 或 T;和 Y,嘧啶)。p53直接调控300多个靶基因的转录。而考虑到间接调节的基因,p53可以调节数千个基因的表达。目前大多数被报道的p53靶基因是蛋白质编码基因,但p53还调节各种非编码 RNA,比如miRNA、lncRNA,甚至circRNA。
为了准确地执行其多方面的功能,p53的表达和活性需要在蛋白质、DNA和RNA水平上受到精细和多层次的调控。
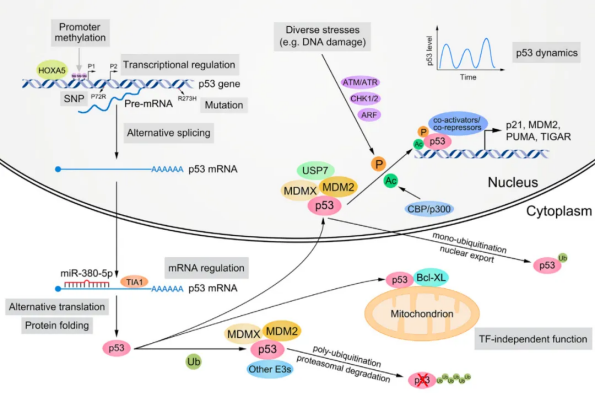
P53蛋白层面的调节
p53蛋白可经历多种类型的PTM,包括泛素化、磷酸化和乙酰化,sumo化等,不同的刺激信号决定PTM的位点和类型。
p53的许多PTM是可逆的。PTM对p53的影响包括改变其蛋白质水平、细胞定位、cofactor招募、靶基因选择性,甚至蛋白质聚集。其中,泛素化、磷酸化和乙酰化在影响p53功能方面最常见且最有影响力。
乙酰化
p53乙酰化的发现是最早发现非组蛋白也可以发生乙酰化的例子。DBD中几个赖氨酸残基的乙酰化对于p53激活的能力至关重要,可以以启动子特异性的方式影响细胞周期停滞、细胞凋亡、衰老、铁死亡和mTOR通路。p53乙酰化在肿瘤抑制中的作用可以通过一系列乙酰化缺陷型(KR mutation)基因敲入小鼠模型得到最好的说明。
总而言之,多种多样的蛋白修饰类型一起调节了p53的活性。在蛋白质水平上,cofactor是另一个影响p53活性的重要因素。p53蛋白可以与多种cofactor结合,包括activator和inhibitor,这对其蛋白折叠、稳定性、细胞定位、DNA 结合、转录激活能力和靶基因选择有重要影响。
DNA和RNA层面的调节
p53基因拥有两个启动子,从而导致选择性转录起始。p53基因的启动子区域可以发生DNA甲基化和组蛋白甲基化,从而影响p53基因本身的转录。多种转录因子可以控制p53基因的转录。p53的pre-mRNA可以发生选择性剪接。此外,p53 mRNA的稳定性、细胞定位和翻译都受到严格调控。另外,p53的激活是不是一个简单的“全或无”的模式,而是一个高度动态的过程。细胞的异质性、刺激的特性、上述多样化的调控因素以及其下游靶基因的稳定性共同决定了p53活性的动态变化。
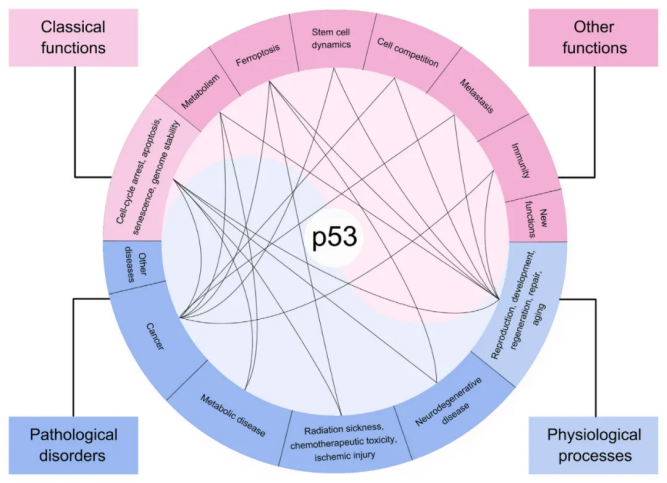
p53的功能:多样性与复杂性
细胞周期停滞、凋亡、衰老与基因组稳定性
诱导细胞周期停滞、凋亡和衰老是p53最早被发现的几项功能。各种刺激信号可以诱导p53发挥这些功能,其中DNA损伤是最有效的刺激类型。DNA损伤后,p53蛋白被稳定并激活以阻止细胞周期进行,为细胞提供时间窗口和足够的物质和能量,以修复受损的DNA。如果损伤太严重而无法修复,p53就会引发细胞凋亡和衰老,以消除受损的细胞。值得注意的是,p53激活的结果还取决于细胞和DNA损伤的类型。这三种功能被广泛认为是p53预防肿瘤发生的主要屏障。另外,p53也能被CRISPR-Cas9编辑基因组时产生的DNA损伤激活,从而降低基因编辑的效率。
另一方面,未能消除受损细胞会导致基因组不稳定。p53的缺失,包括失杂合性(LOH)和双等位基因失活或缺失,会促进基因组不稳定并驱动肿瘤细胞基因组的进化。p53被誉为“基因组的守护者”。p53可以直接促进DNA伤修复。事实上,许多p53靶基因有助于DNA修复过程。然而,目前仍不清楚p53介导的这些DNA修复相关靶基因的激活是否足以独立于其他p53功能从而抑制肿瘤发生。
免疫功能
p53的另一个重要功能是调节免疫反应。p53通过多种机制在先天免疫和适应性免疫中发挥作用。肿瘤细胞和非肿瘤细胞中的p53协同构建肿瘤抑制免疫网络。在肿瘤细胞中,p53通过上调miR-34间接抑制PD-L1表达,使肿瘤细胞对抗肿瘤免疫反应和免疫治疗敏感。p53激活cGAS-STING通路以诱导抗肿瘤活性。在小鼠肝癌模型中,恢复p53表达会诱导肿瘤细胞衰老,引发炎症细胞因子的释放,并引发先天免疫反应以消灭肿瘤细胞。
在肝星状细胞中,p53诱导的细胞衰老也表现出肝癌抑制作用—通过建立衰老相关分泌表型(SASP),可增强M1巨噬细胞极化以维持肿瘤抑制性TME。在小鼠骨髓前体细胞的亚型中,p53驱动其分化为Ly6c+CD103+单核抗原呈递细胞,从而增强抗肿瘤免疫。
肿瘤细胞或TME细胞中p53的缺失可以将肿瘤抑制性免疫微环境逆转为免疫抑制状态,促进肿瘤细胞的免疫耐受或逃逸,或建立有利于肿瘤转移的炎症环境。突变的p53可能会刺激肿瘤细胞免疫逃避。有趣的是,p53突变体本身可以产生作为肿瘤免疫治疗靶点的肿瘤抗原。
p53也参与自身免疫反应和针对各种病原体的免疫防御。值得注意的是,并非p53的所有免疫相关活性都会促进免疫细胞功能或有益于健康。p53可能抑制某些T细胞亚型的增殖和功能。例如,p53抑制抗原非特异性CD4+T细胞增殖,这一过程可以通过T细胞受体(TCR)信号通路消除。一些病毒依赖于p53引起细胞周期停滞来进行复制。
抑制肿瘤转移
p53以细胞自主和非自主的方式在多个阶段抑制转移。在肿瘤细胞中,p53限制其移动性和上皮-间充质转化(EMT)过程。循环系统中的转移性癌细胞可能会发生失巢凋亡和铁死亡,这两个过程均可以被p53促进,以防止癌细胞迁移到新位点。在转移扩散的每一步,癌细胞都会采用专门的代谢程序来满足其能量和生物分子的需求,p53则可能抑制这些细胞代谢过程。另一方面,p53塑造了不利于转移的肿瘤微环境(TME)。例如,p53抑制血管生成和淋巴管生成,阻断通过血液和淋巴系统这两条的要转移途径。它还可以维持细胞外基质的完整性,增强肿瘤细胞在其上面的粘附,限制肿瘤细胞的运动。此外,p53还可以激活抑制肿瘤转移的炎症反应。
END
国内唯一一款预防肿瘤型p53注射液,目前在海南博鳌乐城我们合润生物即可注射,需要的咨询可联系公众号后台!






